“Definisco chirale e dirò che possiede chiralità ogni oggetto, figura geometrica, o gruppo di punti, la cui immagine riflessa in una specchio piano, idealmente realizzata, non può essere sovrapposta all’oggetto”. Con queste parole di Lord Kelvin, alla fine dell’Ottocento, il concetto di chiralità fa il suo ingresso nell’agone scientifico. La denominazione chirale origina dal sostantivo greco cheir, che significa mano (per questo parliamo di chirurghi e di chiromanti). Le mani sono, infatti, l’oggetto chirale per eccellenza. La mano destra è l’immagine speculare della mano sinistra, ma le due mani non possono essere sovrapposte l’una all’altra. Un oggetto che può essere invece sovrapposto alla propria immagine viene detto achirale. Una sedia o una matita sono esempi di oggetti achirali. In chimica, il termine chirale si riferisce a molecole che sono identiche per composizione, ma in cui gli atomi possono essere disposti secondo due possibili configurazioni, tali che una sia l’immagine speculare non sovrapponibile dell’altra. La molecola chirale e la sua immagine vengono chiamati enantiomeri (dal greco, parti opposte).
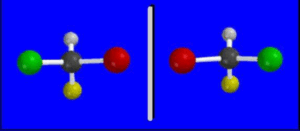

Una caratteristica importante dei composti chirali è la cosiddetta attività ottica, cioè la proprietà posseduta da ciascuno dei due enantiomeri di ruotare il piano di polarizzazione di un fascio di luce polarizzata di uno stesso angolo, ma in direzioni opposte. L’enantiomero che ruota il piano di polarizzazione in senso orario (per un osservatore frontalmente al raggio incidente) viene detto destrogiro; l’altro enantiomero è detto levogiro. L’attività ottica dei due opposti enantiomeri si compensa, in modo tale che se si fa incidere un fascio di luce polarizzata su un campione di sostanza costituito da una eguale quantità dei due enantiomeri (miscela racemica), non si osserva alcuna rotazione del piano di polarizzazione. Si osserverà invece tale effetto, in misura maggiore o minore, in campioni costituiti esclusivamente da un solo enantiomero o in cui uno dei due enantiomeri è presente in maggiore quantità.
Storicamente, è stata proprio l’attività ottica dei composti chirali a permetterne l’identificazione e lo studio. Il primo è stato Louis Pasteur, il futuro scopritore del vaccino contro la rabbia. L’acido tartarico esiste in due forme, la prima era stata isolata dal chimico svedese Carl Wilhelm Scheele nel 1769 e una seconda, conosciuta come acido para-tartarico, nel 1819 dal tedesco Paul Kestner. Fu Pasteur, nel 1847, che isolò nell’acido tartarico racemico le due forme omochirali sinistra e destra per cristallizzazione e le identificò.
Uno dei più affascinanti campi di ricerca moderna riguarda la scoperta dell’origine della chiralità a livello molecolare. Infatti la vita è chirale, essa utilizza preferibilmente uno dei due enantiomeri. Così gli zuccheri, come il desossiribosio nel DNA e il ribosio nel RNA, che contengono e trasferiscono le informazioni genetiche, sono destri, mentre i venti amminoacidi, esclusa la glicina, che sono alla base delle proteine e sono essenziali per le trasformazioni strutturali e chimiche nelle cellule, sono di tipo levo, sinistro. Questo significa che i nostri recettori sono estremamente selettivi. La metafora, che normalmente si usa in questi casi, dovuta al premio Nobel per la chimica del 1902, Emil Fischer, è quella della chiave e della serratura. Solo un tipo di enantiomero si adatta perfettamente al sito del recettore, come per ogni serratura esiste una e una sola chiave. Ad esempio il limonene, un idrocarburo aliciclico, è chirale: esiste un limonene destro (d-limonene) e uno sinistro (l-limonene). Ebbene il nostro naso, con i suoi recettori, è in grado di distinguerli senza sforzo: una forma è alla base dell’odore dell’arancio, l’altra di quello del limone. Malgrado oltre un secolo e mezzo di studi, ancora non è chiaro come e quando questa naturale preferenza per la destra o la sinistra sia sorta. Non abbiamo ancora compreso se l’origine della omochiralità biomolecolare sia fisica, e quindi precedente all’avvento del vivente, prebiotica, o dovuta a processi di tipo evolutivo. La scoperta nella meteorite di Murchison, caduta in Australia nel 1969, di un amminoacido in prevalente forma levogira, l’alanina, sembrava far propendere per la prima ipotesi, ma a inizio 2025 uno studio su campioni estratti da una sonda spaziale sull’asteroide Bennu hanno rivelato la presenza di 14 amminoacidi in forma mista, racemica. La ricerca è ancora aperta.
Ma questa non è l’unica ragione per lo studio della chiralità. Infatti molti farmaci sono chirali e si è scoperto che solo uno dei due enantiomeri (detto eutomero) gode della particolare attività farmaceutica desiderata mentre l’altro enantiomero (distomero) è dotato di attività significativamente inferiore o nulla. Ad esempio l’ibuprofene ha un enantiomero che svolge la funzione di analgesico e antiinfiammatorio, mentre l’altro enantiomero è inattivo. Risulta così sempre più importante la produzione farmaci dotati di una sola forma chirale. Un esempio è lo l-dopa, un precursore della dopamina, che si utilizza per chi soffre del morbo di Parkinson.
Vi sono, purtroppo, altri esempi ben più pericolosi, come nella tragedia della talidomide. La talidomide (N-ftalimido-glutarimide) è una molecola chirale, prodotta in forma di racemo, che fu venduta negli anni cinquanta e sessanta come farmaco, sedativo, antiemetico e ipnotico. La talidomide fu messa in commercio nel 1957 dalla ditta tedesca Chemie Grünenthal con il nome commerciale di Contergan. Il farmaco oltre che in Germania venne venduto in altri 46 paesi del mondo. Nel pubblicizzare la talidomide si sottolineava in modo particolare la sua completa atossicità, raccomandandone l’uso anche per i neonati e i bambini. Il Contergan veniva anche descritto come il miglior farmaco da somministrare come calmante alle gestanti e alle madri che allattano poiché “non danneggia né la madre né il bambino”. Nel 1959 cominciarono ad arrivare le prime segnalazioni di effetti avversi da talidomide, riguardanti la possibilità di polineuriti periferiche negli adulti. Alla fine del 1960 pediatri e genetisti tedeschi iniziarono poi a notare la nascita di un certo numero di bambini con strane e terribili malformazioni, tra le quali la focomelia (dal greco phoke = pinna e melos = arto), dove gli arti superiori e/o inferiori non risultavano sviluppati in parte o del tutto. Durante un congresso di pediatri nel novembre del 1961, fu suggerito che queste malformazioni potessero essere collegate all’uso della talidomide. Quasi contemporaneamente il ginecologo australiano McBride compiva la stessa deduzione ed inviava una lettera, diventata famosa, alla rivista scientifica Lancet. Lentamente, con resistenze dell’industria farmaceutica, nei diversi paesi, la talidomide venne infine ritirata dal commercio. Quello che era successo era che mentre la forma destra della molecola aveva un effetto sedativo sulla madre, quella sinistra produceva un effetto teratogeno sul feto. Complessivamente è stato stimato che da 10 000 a 20 000 bambini siano nati con malformazioni legate all’uso della talidomide, mentre non si è mai conosciuto con esattezza il numero degli aborti e dei bambini nati morti per via di questo farmaco. È interessante notare che gli USA si risparmiarono la tragedia della talidomide. Infatti la richiesta di commercializzazione venne bloccata dalla Dr.ssa Frances Kelsey della Food and Drug Administration (che fu per questo in seguito insignita della più alta onorificenza civile da parte del presidente Kennedy) proprio per i forti dubbi sulla sua sicurezza in gravidanza, dubbi che nascevano dai sintomi di neuropatie periferiche verificatisi negli adulti.
La vicenda della talidomide evidenzia così l’importanza della separazione degli enantiomeri nella produzione e nell’uso dei farmaci, e la necessità di una discussione sull’affidabilità dei test, sul comportamento dell’industria farmaceutica e degli enti di controllo, sulla necessità di sorvegliare i farmaci dopo la loro commercializzazione.
Stefano Ossicini
Per saperne di più
- S. Tagliagambe, Chiralità. La vita e l’antinomia, Mimesis, 2021.
- A. Giacon, Talidomide. Il grande silenzio, Mursia, 2019.
- S. Ossicini, L’universo è fatto di storie, non solo di atomi. Breve storia delle truffe scientifiche, Neri Pozza, 2012.
