L’atomo fu per molto tempo considerato la più piccola parte della materia. Molta strada, nella comprensione dell’infinitamente piccolo è stata fatta e da circa un secolo si è assestata su un modello che di seguito è descritto. Capire quale sia la visione attuale dell’atomo è la partenza per comprendere la Natura, almeno per quel che riguarda l’infinitamente piccolo. E anche per capire un sacco di strumenti e oggetti che usiamo abitualmente.
È una svolta. Uno è indeciso se andare a fare una passeggiata o no, ma quando si mettono le scarpe, i dubbi sono scomparsi: si va. È come saltare il fosso. Capire l’atomo è la stessa cosa: si parte per l’avventura, che in questo caso consiste nell’affrontare l’infinitamente piccolo. Tutta la materia, ma proprio tutta, è fatta da tanti atomi, ma proprio tanti. Prima, però, alcune avvertenze. Non fissiamoci sulla domanda; ma come fanno a dire che è fatto così? Come fanno a essere sicuri? Direi, c’è molta più incertezza nel cuocere la pasta o fare un risotto che in queste cose. Ci sono circa cento tipi di atomi e con questi si costruisce tutta la materia dell’Universo. Ciascun tipo di atomo ha un nome: idrogeno, carbonio, azoto, ossigeno, alluminio, ferro, oro, piombo ecc. Ciascun tipo è diverso dagli altri. Che cosa vuol dire? Vuol dire, per esempio, che gli atomi di idrogeno sono tutti uguali fra loro, ma sono diversi dagli atomi di azoto. Tra breve vedremo in cosa differiscono l’un l’altro.
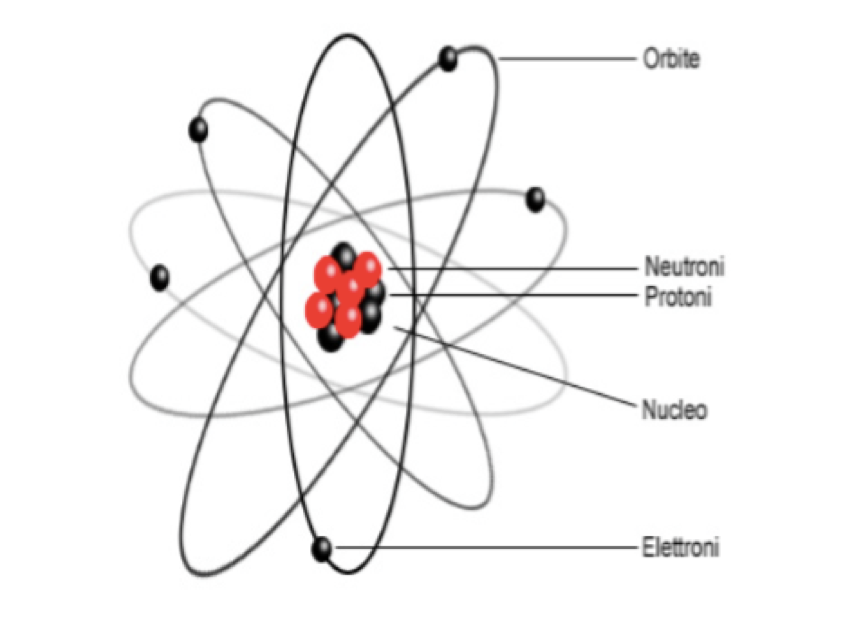
Veniamo a descrivere l’atomo. Ciascun atomo è composto da tre pezzi: protone, neutrone ed elettrone, e fin qui, credo, ci siamo. Immaginate di voler costruire degli atomi: avrete bisogno di un cassetto pieno di protoni, un altro con neutroni e un altro con elettroni. Secondo gli atomi che volete costruire (idrogeno oppure azoto, oppure ossigeno ecc.) dovete prendere un ben preciso numero di protoni, neutroni ed elettroni da ciascun cassetto e metterli assieme. Vediamo le regole che segue la Natura:
- il numero di protoni e quello di elettroni devono essere uguali. Questo vuol dire che ne dovete prendere lo stesso numero dal cassetto dei protoni e da quello degli elettroni.
- il numero di neutroni, invece, è meno certo: è consigliabile prendere tanti neutroni quanti sono i protoni, ma non è tassativo. Lo dice già il nome – neutrone – si comporta un po’ come quelli che non sono troppo di compagnia e stanno lì taciturni, uno in più uno in meno cambia poco nell’economia della festa.
Protoni, neutroni ed elettroni che avete preso dai cassetti e messi vicini in realtà si sistemano in modo da rispettare le regole imposte dalla Natura. La Natura o meglio le forze della Natura sono tali che costringono protoni e neutroni a stare molto vicini, e formare quello che è detto nucleo dell’atomo. Gli elettroni, invece, girano attorno al nucleo. Bisogna qui introdurre una frase necessaria per non complicarci la vita: “Tutto avviene come se…”. Nessuno ha mai visto un atomo e ogni descrizione a parole è forzatamente imprecisa. Dire che girano attorno al nucleo fa storcere il naso al fisico quadratico medio, ma non importa… Pensiamolo come a un moto attorno al nucleo. Adesso ci siamo, o quasi; ogni tipo di atomo – idrogeno, ossigeno, alluminio, ferro – ha un preciso numero di protoni ed elettroni. L’idrogeno ne ha uno, l’azoto ne ha sette, l’ossigeno ne ha otto, l’alluminio ne ha tredici, e il ferro ne ha ventisei ecc. In pratica a ciascun numero di protoni da 1 a circa 100 corrisponde un diverso tipo di atomo a cui abbiamo dato un nome.
Facciamo un altro passo: gli elettroni, che si muovono attorno al nucleo, si comportano come se fossero legati al nucleo con elastici. Per semplicità si può pensare che ciascun elettrone abbia una sua orbita, un suo movimento. Immaginatelo come un pianeta attorno al Sole, ma non ditelo a voce alta perché, se c’è un saputello nelle vicinanze, vi dirà che siete ignoranti. Inoltre la forza degli elastici diminuisce man mano che gli elettroni hanno orbite maggiori. Invece nel nucleo, protoni e neutroni è come fossero legati fra loro da elastici ben più robusti di quelli che legano gli elettroni al nucleo. Adesso, possiamo immaginare gli atomi con protoni e neutroni contenuti nel nucleo e ben legati da una forza (detta nucleare) e gli elettroni legati al nucleo da una forza (detta elettrica). In verità l’elastico che lega gli elettroni al nucleo è fornito dai protoni. I neutroni sono soltanto da compagnia e soltanto i protoni del nucleo si accorgono di loro.
Detto in modo un po’ più preciso: i protoni hanno carica elettrica positiva (+1) e gli elettroni negativa (-1) e i neutroni non hanno carica (0). Alla fine della fiera, essendo il numero di protoni uguale a quello degli elettroni, l’atomo è in totale neutro. (La carica elettrica è una proprietà della materia a cui siamo abbastanza abituati, basti pensare alle pile. Nella pila il positivo è dovuto a un eccesso di protoni e il negativo a uno di elettroni.)
Ancora alcune informazioni di servizio: quasi tutta la materia dell’atomo sta nel nucleo. I protoni e i neutroni hanno massa (quantità di materia) circa uguale e sono 2000 volte più pesanti degli elettroni. Se, con un esempio nel nostro mondo, gli elettroni pesassero come una pallina da ping-pong (4 g), i protoni e neutroni peserebbero circa 8 kg. Le proporzioni delle dimensioni, invece, s’invertono: il nucleo si può immaginare come una sfera che contiene tante sferette, fatte da protoni e neutroni. E il raggio del nucleo è circa un centomillesimo di quello delle orbite degli elettroni. Per riassumere la questione delle dimensioni: si può immaginare l’atomo come una nuvola sferica con elettroni che si muovono lì dentro e al centro, piccolissimo, il nucleo con protoni e neutroni, che d’altro canto forniscono quasi tutta la massa.
Quant’è grande la nuvola sferica che rappresenta un atomo o, se si vuole, quanto vale il raggio di un atomo? Dipende un po’ dal numero di protoni e di elettroni; va da qualche decina a qualche centinaio di milionesimi di micrometri. È più facile con un esempio: se mettiamo degli atomi di ferro allineati lungo una linea, ne occorrono circa sette milioni per fare un millimetro di lunghezza. OK, molti. E veniamo alla parte più difficile: le orbite degli elettroni. A ciascuna orbita (ove per orbita s’intende il raggio dell’anello che percorre l’elettrone) si associa una velocità (o energia) dell’elettrone che la occupa e quindi un tipo ben preciso di elastico che tiene l’elettrone sulla sua orbita. Ciascun tipo di atomo ha una serie di orbite possibili per gli elettroni. (Uno studente di fisica ha gli strumenti – le formule – per calcolarle.)
Sì, non tutte le orbite sono possibili. E qui si complica un po’ il discorso. Con un esempio: se andate su una strada in salita, si può, allungando o accorciando i passi, muoversi a piacere in altezza. Se invece salite con una scala, a ogni scalino ci si muove verso l’alto di una quantità che è l’altezza dello scalino. Ecco, le orbite degli elettroni sono a scalini. Uno scalino è detto quanto (dal latino quantum), da cui il nome meccanica quantistica. Per ciascun tipo di atomo sono permesse determinate orbite e, di conseguenza, energie. E gli elettroni di un atomo occupano le orbite permesse a partire da quelle più interne. Se l’atomo ha otto elettroni (questo è l’ossigeno), questi occupano le prime otto orbite possibili. Ce ne sono altre orbite disponibili e queste sono più lontane dal nucleo, e vengono occupate soltanto in condizioni particolari delle quali non parliamo qui. Con questo modello in mente si possono capire un sacco di cose e si è introdotto il concetto dei quanti, cioè del fatto che le energie possibili non sono tutte le immaginabili, ma sono a scalini e gli scalini non sono tutti uguali fra loro.
Flavio Marchetto
Istituto Nazionale di Fisica Nucleare, sezione di Torino
Dal nostro catalogo: Breve storia dell’infinitamente piccolo, volume 1 e volume 2